
 | ||
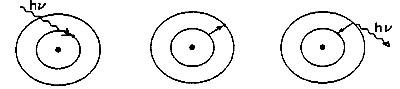
| Atom w stanie podstawowym pochłania foton | Elektron przeskakuje na orbitę o wyższej energii | Emisja fotonu i powrót atomu do stanu podstawowego |
| Mieszanina gazowa | Temperatura | Mieszanina gazowa | Temperatura | ||
| Utleniacz | Reduktor | [oC] | Utleniacz | Reduktor | [oC] |
| NO2 | H2 | 1550 | NO | H2 | 2800 |
| Powietrze | H2 | 2050 | NO | C2H2 | 3100 |
| Powietrze | C2H2 | 2200 | O2 | C2H2 | 3100 |
| N2O | H2 | 2600 | F2 | H2 | 4000 |
| O2 | H2 | 2700 | O2 | (CN)2 | 5000 |
| N2O | C2H2 | 2700 | NO2 | C2H2 | 5000 |
 |
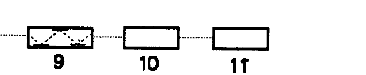 |
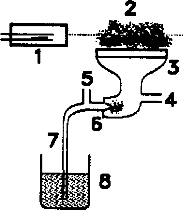
| Schemat spektrometru ASA 1) lampa z katoda wnękowa 2) płomień 3) palnik 4) doprowadzenie gazu palnego 5) doprowadzenie gazu utleniającego 6) nebulizer 7) kapilara zasysająca roztwór 8) roztwór badany 9) detektor 10) miernik impulsu elektrycznego 11) rejestrator lub komputer |
Piotr Ostrega (KCh 1/91)
