

Rys. 1. |
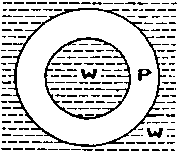
Rys. 2. Antybańka: W-woda, P-powietrze
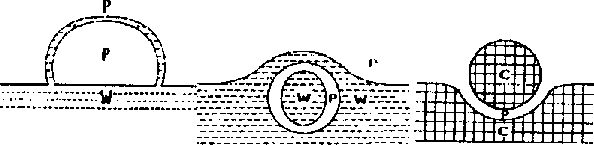
Rys. 3. a) bańka na powierzchni wody b) antybańka
przy powierzchni c) pływająca kropla
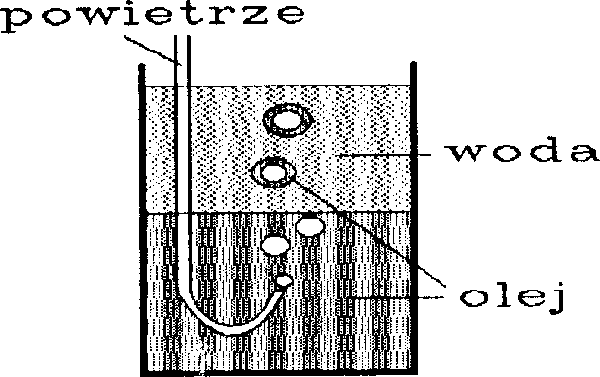
Antybańki wprawdzie opalizują podobnie jak zwykłe bańki, ale znacznie wolniej dążą do powierzchni cieczy. Są przecież prawie pełne roztworu takiego jak ten, który je otacza, więc siła wyporu jest znikoma. Jeżeli zdarzy im się pęknąć, to z byłej otoczki powietrznej powstają maleńkie "zwykłe" bąbelki. Gdy antybańka szczęśliwie osiągnie powierzchnię nie wynurza się i nie staje się (wbrew pozorom!) "przeciwnością" bańki pływającej po powierzchni cieczy (rys.3). Zjawiskiem w którym ciecz i gaz zamieniły się miejscami w stosunku do bańki pływającej po powierzchni są pływające krople.
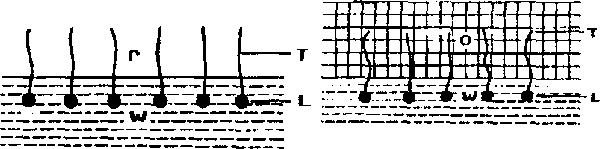
Rys. 4. Cząsteczki środka powierzchniowo czynnego na
granicy faz a) woda-powietrze b) woda-olej. T-hydrofobowy "ogon", L-lipofobowa "główka".
Podobne struktury można także otrzymać np. w układzie woda-olej. Można by się tego zresztą spodziewać zwróciwszy uwagę na podobieństwo w rozmieszczeniu cząsteczek substancji powierzchniowo czynnej na granicach faz woda-powietrze i woda-olej.
Zachęcam do samodzielnych badań.
Dariusz Paradowski
Literatura: Journal of Chemical Education [1988] str. 608
KCh 3/91
Komentarz czytelnika stron ChemFana:
Od razu pragnę się przyznać, ze jestem na tej stronie po raz pierwszy. Moja
uwagę przyciągnęło zaproponowane przez Pana Dariusza Paradowskiego doświadczenie
zatytułowane "Banki i antybańki". Gratuluje serdecznie ciekawego pomysłu;
rzeczywiście jako doświadczenie szkolne może być bardzo pomocne, szczególnie w szkole podstawowej (teraz
już w gimnazjum), gdzie liczy się przede wszystkim zainteresowanie ucznia tematem, a w szkole podstawowej lub w gimnazjum
można to tylko osiągnąć przygotowując ciekawe i widowiskowe doświadczenia. Podoba mi
się również opracowanie teoretyczne załączone do doświadczenia. Polecam też
zastanowić się nad przyczyna dość ciekawego zachowania się surfaktantów (z j. ang.
środek powierzchniowo czynny) w różnych rozpuszczalnikach, po przekroczeniu pewnego
dość charakterystycznego stężenia zwanego krytycznym stężeniem micelarnym (c.m.c.). Polecam "Fizyko-chemię powierzchni" autorstwa Danikiewicza, oraz
wymianę poglądów na temat surfaktantów ze mną pod adresem:
rafciu@ichf.edu.pl.
Z wyrazami szacunku
mgr
Rafał Świerzewski, Zakład Kalorymetrii, Instytut Chemii Fizycznej
Polskiej Akademii Nauk, Warszawa.
Komentarz wpłynął do ChemFana dn. 1999-10-11
