
W niniejszym opisie powoływano się już na takie analogie, jak modele oscylatora hydraulicznego, elektrycznego i ekologicznego przy opisie reakcji oscylacyjnych lub do analogii działania suwaka zamka błyskawicznego z funkcjonowaniem enzymu. Proponowane niżej przykłady mogą razić swoją prostotą. Wynik niektórych z eksperymentów jest tak oczywisty, że ich wykonywanie można uznać za zbędne. Doświadczenia takie nazywane są niekiedy "eksperymentami myślowymi". Czasami jednak spotyka się opis zaskakująco skomplikowanego modelu, jak np. model komputera opartego na bistabilności chemicznej reakcji oscylacyjnej.
Śruby i nakrętki czyli stechiometria i pojęcie mola
Początkującym chemikom sprawia trudność zrozumienie celowości posługiwania
się jednostkami liczności materii - molami w miejsce klasycznych
jednostek masy - gramów. Dla niezbyt zaawansowanego chemika pewną trudność może
stanowić następujący problem. Do reakcji użyto 100 g CH3COOH i 90 g
NaOH. Której substancji użyto w nadmiarze (i czy w ogóle użyto nadmiaru)?
Identyczne problemy ma każdy, kto w sklepie metalowym kupił 100 g dużych śrub i 90 g małych nakrętek i zastanawia się, czy są one w ilościach "do pary".
Dlatego w sklepie metalowym (podobnie jak w chemii) operowanie jednostkami masy
(gramy) jest niewygodne. Rozsądniejsze byłoby wyrażanie mas jednostkowych
wszystkich wyrobów nie w gramach, ale w wielokrotnościach masy najmniejszego
elementu w magazynie. Do celów praktycznych najwygodniejsze byłoby operowanie
artykułami paczkowanymi np. po 12 sztuk (tuzin). ("Proszę o trzy paczki śrub i
trzy paczki nakrętek!"). Dokładnie takie rozwiązanie przyjęto od dawna w
chemii ! Jako jednostkę masy atomowej i cząsteczkowej przyjęto (pierwotnie)
masę pojedynczego atomu najlżejszego pierwiastka - wodoru. Operowanie w chemii
jednostkami liczności (mole) zamiast jednostkami masy (gramy) nie jest więc
abstrakcyjnym dziwactwem, lecz podyktowane jest rzeczywistą wygodą.
Trudno powstrzymać się od refleksji dotyczącej metod dydaktycznych większości
nauczycieli chemii. Wprowadzenie do chemicznych jednostek liczności najczęściej
odbywa się następująco: "Proszę zapisać w zeszycie definicję: mol jest
to [---]. A na następnej lekcji zrobimy sprawdzian z nauczenia się tej
definicji na pamięć!" Nauczyciele chemii w szkole powinni najpierw uzasadnić
celowość operowania jednostkami liczności zarówno w chemii, jak i w życiu
codziennym, a dopiero potem wymagać uczenia się na pamięć definicji mola!
Inaczej trudno się dziwić, że tak wielu maturzystów nie tylko nie rozumie
chemii, ale wręcz jest do końca życia do chemii uprzedzonych.
Wracając do problemu stechiometrii, stosunek masy śrub do masy nakrętek
powinien być taki, jak masa jednej śruby ma się do masy jednej nakrętki.
Podobnie, masy CH3COOH i NaOH powinny pozostawać w proporcji
identycznej, jak stosunek ich mas cząsteczkowych, a więc 60 : 40 = 100 g
CH3COOH : 66,7 g NaOH. 90 g NaOH stanowi więc nadmiar (!) w
stosunku do 100 g CH3COOH (90 g NaOH zamiast teoretycznych 66,7 g
NaOH). Nadmiar ten wynosi 90 : 66,7 = 1,35 raza, czyli 135%.
O wiele prostsze jest stosowanie od razu chemicznych jednostek liczności.
100 g CH3COOH = 100 g : 60 g/mol = 1,67 mola CH3COOH,
natomiast 90 g NaOH = 90 g : 40 g/mol = 2,25 mola NaOH. W nadmiarze jest
oczywiście NaOH, a nadmiar ten wynosi 2,25 : 1,67 = 1,35 raza. Ilością
stechiometryczną NaOH byłoby 1,67 mola czyli 1,67 mola 40 g/mol = 66,7 g NaOH.
Czytelnik zapewne nie będzie miał kłopotu z udzieleniem odpowiedzi na
identyczne pytanie, dotyczące jednak zmieszania 100 g CH3COOH i
100 g NaOH.
Przyczyna aktywności optycznej
Obrót płaszczyzny światła spolaryzowanego przechodzącego przez roztwór
chiralnych cząsteczek następuje w wyniku oddziaływania światła z elementami
budowy cząsteczki. Jeśli światło przechodząc wzdłuż takiej cząsteczki doznaje
skręcenia płaszczyzny polaryzacji np. "w prawo" (poprawniej: w kierunku zgodnym
z kierunkiem ruchu wskazówek zegara), to w przypadku przechodzenia wzdłuż
takiej samej cząsteczki, odwróconej jednak o 180o, powinno nastąpić
takie samo skręcenie, ale "w lewo". I konsekwentnie: wiązka światła
spolaryzowanego przechodząc przez roztwór będący zbiorowiskiem chiralnych
cząsteczek ułożonych przecież w przypadkowy, chaotyczny sposób, powinna
doznawać wypadkowego skręcenia równego zero. Takie są typowe nieporozumienia
związane z przyczynami czynności optycznej. Należy pamiętać, że chiralne
cząsteczki mają niezwykłą właściwość geometryczną, którą zachowują niezależnie
od przypadkowego ułożenia w przestrzeni! Najprostsze jest odwołanie się do
analogii z nieocenionymi śrubami i nakrętkami... Bardzo przydatne są duże
plastikowe śruby, stanowiące element zestawu do zabawy dla dzieci.
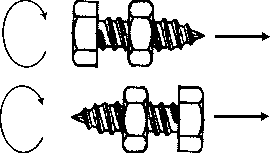
Nakrętka symbolizuje chiralną cząsteczkę, a śruba symbolizuje wiązkę światła spolaryzowanego. Eksperymentator usytuowany od lewej strony
usiłuje przemieścic śrubę w stosunku do nieruchomej nakrętki, w kierunku
wskazanym przez strzałkę. Dokonać tego można przez wkręcanie śruby
zgodnie z kierunkiem obrotów wskazówek zegara. Odwrocenie modelu o 180o
(dolny rysunek) nie zmienia rezultatu doświadczenia, śrubę również i
tym razem trzeba obracać "w prawo"! Wynik tego doświadczenia powinien
być oczywisty, z reguły jednak jest zaskakujący dla słuchaczy.
Dlaczego tylko "L" aminokwasy ?
Prawie wszystkie (poza glicyną) aminokwasy mogą istnieć w postaci dwóch izomerów optycznych: "L" i "D". W typowych białkach i peptydach spotykanych w organizmach żywych występują jednak niemal wyłącznie aminokwasy szeregu "L". Nielicznymi wyjątkami są pewne peptydy pełniące tak specjalne funkcje, jak np. antybiotyki peptydowe. Na homochiralność aminokwasów (i cukrów) występujących w żywych organizmach zwrócił uwagę Ludwik Pasteur już w 1860 roku. Można więc postawić dwa pytania:
* Wydaje się, że "prawoskrętność" wybrano przypadkowo. Niewielki wpływ na to mogła mieć praworęczność większości ludzi.
Fakt, że w naturze spotyka się niemal wyłącznie polipeptydy zbudowane z
aminokwasów jednego tylko szeregu: "L", ogromnie zwiększa wydajność i
szybkość procesów syntezy, gdyż odpada konieczność etapu rozpoznawania
chiralności substratu - aminokwasu oraz odrzucania cząsteczek "nie pasujących".
Jest to również oszczędność materiałowa. Prócz tego upraszcza się
"oprzyrządowanie" biochemiczne w postaci wyposażenia organizmów w enzymy
uczestniczące w przemianach takich diastereoizomerycznych substancji. Trzeba
pamiętać, że przy 21 tzw. kodowanych aminokwasach, możliwość występowania
większości z nich w dwóch formach przestrzennych powoduje astronomiczne wręcz
zwiększenie liczby kombinacji budowy produktu - polipeptydu!
"Prawidłowa" budowa przestrzenna ma znaczenie decydujące dla aktywności
biologicznej biopolimerów. Wydaje się, że błędy podczas biosyntezy tych
skomplikowanych struktur prowadzą do wyjątkowo niekorzystnych następstw
biologicznych dla popełniających je organizmów. Ostatnio powstała teoria, że
biocząsteczki o takiej omyłkowej strukturze są odpowiedzialne za wiele
schorzeń, np. chorobę Kreutzfelda-Jacoba. Ograniczenie elementów budulcowych do
elementów jednego tylko rodzaju ogromnie zmniejsza prawdopodobieństwo takich
omyłek. Organizmy, które nie potrafiły w toku ewolucji przyjąć tego optymalnego
rozwiązania, już dawno padły ofiarą niekorzystnych skutków. Obecnie uważa się,
że homochiralność jest jedną z najbardziej charakterystycznych cech
życia w tej formie, która nas otacza. Jak konsekwentnie i skutecznie zasada ta
jest realizowana w przyrodzie, niech świadczy przykład z chemii cukrów, gdzie
uprzywilejowane są izomery "D". Stosunek zawartości D-glukozy do
L-glukozy w żywych organizmach wyraża się liczbą
1_000_000_000_000_000_:_1 ! Jest to tym bardziej zdumiewające, że zgodnie z
termodynamiczną zasadą wzrostu entropii istnieje naturalna tendencja do ciągłej
racemizacji enancjomerów. Do tego procesu Przyroda ma stosunek aktywny,
polegający na ciągłej eliminacji powstającego samorzutnie niepożądanego
enancjomeru. Jest to widocznie tak ważne dla zachowania sprawności
funkcjonowania organizmu, że na taki proces przeznaczana jest pewna część
energii życiowej.
Poważnym problemem może być zastosowanie chiralnych leków. Jeśli są to
substancje nienaturalne, syntetyczne, to stanowią one z reguły mieszaninę
enancjomerów lub diastereoizomerów. Najczęściej właściwości terapeutyczne ma
tylko jeden z izomerów. Właściwości drugiego izomeru, obecnego z reguły w
mieszaninie, mogą być wręcz szkodliwe. Najbardziej dramatycznym przykładem są
teratogenne właściwości Thalidomidu (Conterganu). Lek ten wprowadzony
do obrotu w latach 60-tych, miał być nieszkodliwym środkiem uspokajającym dla
kobiet w ciąży. W wyniku jego stosowania narodziło się kilka tysięcy dzieci z
niedorozwojem kończyn. W obrocie znajdowała się racemiczna mieszanina obu
enancjomerów. Jeden z enancjomerów miał działanie deformujące płód.
Praca wpłynęła do Chemfana: 11-12-1998
