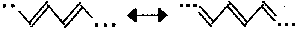Najprostsz otrzymany w laboratorium polimer organiczny to poliacetylen (CH)n, którego wzór można zapisać w postaci struktur granicznych:
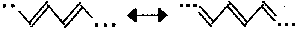
Rys. 2. Struktury graniczne polacetylenu.
Orbitale tworzące sprzężone wiązania podwójne węgiel-węgiel nakładają się na siebie i w rezultacie tworzą tzw. pasmo energetyczne, a zarazem drogę po której mogą przemieszczać się elektrony. Jednak nie wystarczy to do otrzymania dobrego przewodnika. Jaki jeszcze warunek musi być spełniony? Chcąc to wyjaśnić, przyjrzyjmy się przez chwilę pasmowemu modelowi ciała stałego, gość dobrze opisującemu własności elektryczne metali i półprzewodników.
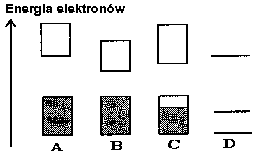
Rys. 3. Zapełnienie poziomów energetycznych.
a)izolator b)półprzewodnik
c)metal d)pojedyncza cząsteczka
|
Elektrony w pasmie energetycznym, powstałym z nałożenia orbitali, mogą mieć dowolną energię, ale tylko w pewnym ściśle określonym przedziale (rys. 3). Polimer lub substancja nieorganiczna zwykle zawiera więcej pasm energetycznych, oddzielonych szerszą lub węższą przerwą energetyczną, ale elektrony nie mogą mieć energii odpowiadającej obszarowi między pasmami. Przypadek przedstawiony na rys. 3a jest typowy dla izolatorów. Pasmo o niższej energii (pasmo walencyjne) jest całkowicie zapełnione elektronami, a puste pasmo o energii wyższej (pasmo przewodnictwa) jest oddzielone od pasma walencyjnego dość szeroką przerwą energetyczną. Ponieważ pasmo walencyjne jest całkowicie zapełnione, nie ma możliwości wywołania uporządkowanego przepływu elektronów, czyli przepływu prądu. Przypomina to w pewnej mierze sytuację zatłoczonego autobusu, w którym nie można wykonać żadnego ruchu. Układ pasm anergetycznych poliacetylenu właśnie odpowiada schematowi przedstawionemu na rys. 3a. Dla półprzewodników (rys. 3b) przerwa energetyczna jest węższa, pod wpływem światła albo ciepła może nastąpić przeniesienie elektronu do pasma przewodnictwa. Wtedy pojawia się możliwość przenoszenia prądu, bo zarówno wzbudzony elektron może pomieścić się w pasmie przewodnictwa, ale także w pasmie walencyjnym pojawi się nieco swobody ruchu.
Inaczej jest dla metali. Tutaj pasmo walencyjne wypełnione jest tylko częściowo, wystarczy minimalna energia, aby wzbudzić elektron do niezajętej części pasma i w rezultacie umożliwić mu swobodny ruch w materiale.
Tak przedstawiony obraz już sugeruje dwa sposoby zwiększania przewodnictwa poliacetylenu. Można albo wprowadzić z zewnątrz elektrony do pustego pasma przewodnictwa, albo zabrać część eletronów z pasma walencyjnego. Fizyk nazwie proces taki domieszkowaniem, ale chemik użyje innego określenia. Zwróćmy uwagę, że tak rozumiane domieszkowanie jest z chemicznego punktu widzenia redukcją lub utlenianiem polimeru. I tak, na przykład wprowadzenie jodu prowadzi do utlenienia poliacetylenu. Wówczas dodatni ładunek łańcucha polimerowego, powstały w wyniku zabrania części elektronów z pasma walencyjnego, jest zobojętniany jonami jodkowymi, powstającymi w reakcji i wbudowującymi się w matrycę polimerową. Natomiast do redukcji poliacetylenu można użyć metali alkalicznych np. litu.
(CH)n + 1/2I2 --> (CH)n+I-
(CH)n + Li --> (CH)n-Li+
Przewodnictwo właściwe [S*m-1]
| Nazwa polimeru | Wzór | Symbol |
| Poliacetylen | 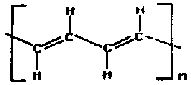 | PA |
| Polipirol | 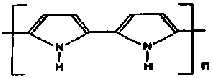 | PPy |
| Politiofen | 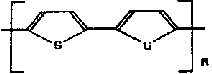 | PTh |
| Poli-para-fenylen | 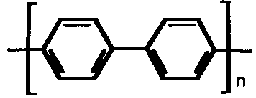 | PPP |
| Polianilina | 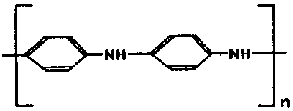 | PANI |
Wówczas ujemny ładunek łańcucha zobojętniają kationy tych metali.
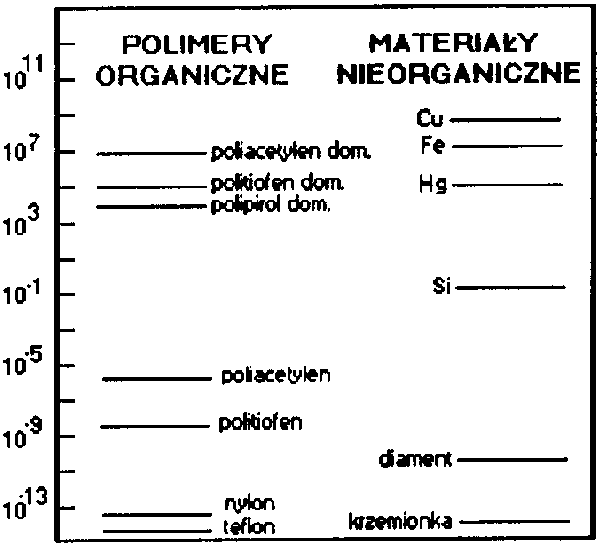
Taka interpretacja procesu domieskowania, choć wyjaśnia kierunek zmian przewodnictwa, jest jednak uproszczona. Zainteresowanym problemem polecamy literaturę podaną przy końcu artykułu. Jest faktem, że dla obu sposobów domieszkowania uzyskuje się kolosalny wzrost przewodnictwa (rys. 4), w korzystnych warunkach wynoszący ponad dwanaście rzędów wielkości (bilion razy!), a otrzymany polimer może osiągnąć nawet przewodnictwo miedzi.
Ze względu na prostotę budowy, poliacetylen był dogodnym obiektem badań podstawowych, zmierzających do wyjaśnienia mechanizmów przewodnictwa, niemniej okazał się materiałem zbyt mało trwałym, aby mógł liczyć na szersze wykorzystanie. Utlenia się w kontakcie z powietrzem, jest praktycznie nierozpuszczalny, łatwo ulega rozkładowi w wyższych temperaturach.
W ostatnich latach rozwijano badania innych polimerów (tabela), które również okazały się dość dobrymi przewodnikami, ale zarazem były znacznie trwalsze od poliacetylenu. Wspólną cechą materiałów opisanych w tabeli (poza poliacetylenem) jest sposób syntezy, niebywale prosty, jak na tak nietypowe materiały. Na przykład, aby wytworzyć polipirol, należy przygotować roztwór pirolu w odpowiednim rozpuszczalniku, powiedzmy w acetylonitrylu (CH3CN) z dodatkiem elektrolitu zapewniającego przewodnictwo roztworu, np. nadchloranu litu LiClO4. Od rodzaju zastosowanego przewodnika zależą w pewnej mierze właściwości fizyczne polimeru. Do tak przygotowanego roztworu należy wprowadzić elektrodę, np. platynową i przyłożyć do niej potencjał dodatni względem drugiej elektrody zanurzonej w roztworze, ale nie biorącej udziału w interesującym nas procesie (rys. 5). Po przyłączeniu napięcia do elektrod rozpoczyna się elektroliza i elektroda platynowa stopniowo pokrywa się warstwą powstającego w reakcji poliprirolu (rys. 4).
(n+2) C4H5N (pirol) --> PPy (polipirol) + (2n+2)H+ + (2N+2)e-
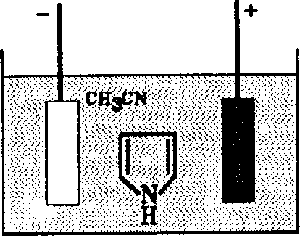
Rys. 4.
|
Jednocześnie polipirol ulega częściowemu utlenieniu (domieszkowaniu), przez co znacznie wzrasta jego przewodnictwo, a wytworzony dodatni ładunek łańcucha polimerowego kompensują aniony elektrolitu (ClO4-), wbudowujące się w tworzoną warstwę. Dzięki temu, że utleniony polipirol przewodzi, można uzyskać stosunkowo grube warstwy polimeru: proces elektrodowy nie zatrzymuje się po zapełnieniu powierzchni elektrody metalicznej.
Utleniony polimer jest jednocześnie membraną jonowymienną. Znajdujące się w nim aniony elektrolitu nie są związane w sposób trwały, mogą być wymieniane na inne aniony. Można wytworzyć także membranę zdolną przyjmować i oddawać kationy.
Stopień utlenienia polimeru nie tylko silnie wpływa na jego przewodnictwo i własności jonowymienne, ale wpływa także na jego barwę.
Badania przewodzących polimerów wymagają współpracy specjalistów z różnych dziedzin: chemii fizycznej i organicznej, fizyki ciała stałego, inżynierii meteriałowej. Miejscem wymiany doświadczeń są m.in. czasopisma naukowe, a wśród nich zwraca uwagę pismo specjalnie poświęcone tym zagadnieniom zatytułowane Synthetic Metals. Prowadzone w tej dziedzinie prace są interesujące nie tylko z czysto poznawczego punktu widzenia. Połączenie w jednym materiale elektrycznych własności metali, fizycznych i chemicznych cech tworzyw sztucznych, dołączenie nietypowych własności optycznych i łatwość syntezy stwarza realną szansę różnorodnych zastosowań. Świadomość tego bywa obecna nawet poza środowiskami naukowymi. Już w 1977r. dziennik amerykański Wall Street Journal pisał: "Jeżeli otrzymane zostaną trwale przewodzące tworzywa sztuczne, liczba możliwych do wyobrażenia zastosowań będzie zadziwiająco duża". Minione lata wprawdzie nieco ostudziły ten optymizm, głównie dlatego, że nie otrzymano jeszcze polimerów dostatecznie trwałych, niemniej perspektywy w dalszym ciągu są obiecujące.
Bardzo bliskie technicznej realizacji są tzw. wskaźniki elektrochromowe, wykorzystujące wspomnianą już zależność barwy polimeru od stopnia jego utlenienia, czyli w rezultacie od przyłożonego potencjału. W odróżnieniu od dzisiaj powszechnie stosowanych wyświetlaczy ciekłokrystalicznych (LCD) mają pewne zalety. Barwa, czyli wskazanie wyświetlacza polimerowego nie zanika po odłączeniu napięcia, a obserwacja wskazań możliwa jest praktycznie pod dowolnym kątem widzenia. Oprócz tego polimer może przyjmować więcej niż jedną lub dwie barwy. Szczególnie wdzięcznie wyglą to dla polianiliny, gdzie płynna zmiana stopnia utlenia pozwala uzyskać barwy w prawie całym zakresie widma widzialnego, od żółtej, przez zieloną, niebieską, fioletową, aż do brunatnej.
 |
| Polimer | Elektrolit | Polimer |
| Rys. 6. |
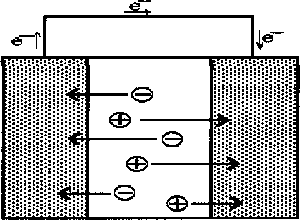
Inna możliwość zastosowań to akumulatory z tworzw sztucznych (rys. 6). Akumulator taki mogą tworyć dwie płytki polimerowe zanurzone w roztworze elektrolitu. Ładowanie akumulatorów polega na jednoczesnym utlenianiu jednej i redukcji drugiej elektrody, czemu towarzyszy wnikanie odpowiednio anionów i kationów elektrolitu do matrycy polimerowej. W czase pracy akumulatora przebiega proces dokładnie odwrotny. Zalety takiego źródła prądu to mały ciężar i znacznie mniejsze zagrożenie ekologiczne, niż w przypadku klasycznych akumulatorów ołowiowych.
Przeszkodą w ich szerszym wykorzystaniu jest podatność na samorozładowanie i niepożądane reakcje, np. nadmierne utlenienie elektrody, czy oddziaływanie z rozpuszczalnikiem prowadzące do degradacji polimeru. Większe sukcesy osiągnięto przy konstrukcji układów, gdzie tylko jedna elektroda jest polimerem. W 1987 roku firmy Bridgestone i Seiko wprowadizły na rynek japoński akumulatory w postaci niewielkich, płaskich krążków, gdzie jedna elektroda była wykonana z metalicznego litu, a druga z polianiliny. Szybkość samorozładowania takiej baterii ocenia się jako dość niską, dzięki czemu jej żywotność powinna być większa, niż akumulatora ołowiowego. Innym ciekawym rozwiązaniem jest produkt niemieckich zakładów BASF i Varta Batterie w postaci akumulatora wykonanego z folii litowej i polipirylowej. Cały zestaw ma grubość około 4mm i rozmiary karty pocztowej. Baterię taką można zginać bez niebezpieczeństwa uszkodzenia, a nawet zwinąć w rulonik.
Membranowe własności polimerów przewodzących można wykorzystać jeszcze inaczej, np. do dejonizowania wody. Zestaw działa podobnie, jak akumulator polimerowy w czasie ładowania, z tym, że kationy i aniony wchłaniane przez sieć polimerową obu elektrod pochodzą z oczyszczanej wody. Regeneracja układu to przyłączenie napięcia o przeciwnym znaku, powodującego usunięcie jonów do roztworu.
Układ o podobnej zasadzie działania ma przed sobą realne perspektywy zastosowań nawet w medycynie, gdzie wymagania dotyczące jakości i niezawodności są, jak wiadomo, szczególnie wysokie. W leczeniu niektórych schorzeń istotne jest podawanie leku w sposób ciągły z określoną szybkością, a jeszcze lepiej, gdy szybkością tą można sterować. Ponieważ wiele leków występuje w postaci kationowej, stąd możliwości wykorzystania polimeru przewodzącego. Materiał taki, odpowiednio zabezpieczony i nasycony lekiem, byłby wszczepiany chorym, a następnie niewielkie napięcie powodowałoby usuwanie kationowego leku z matrycy i wprowadzenie go do leczonej tkanki czy krwiobiegu. Modyfikacja przyłożonego potencjału umożliwiałaby zmianę szybkości dozowania.
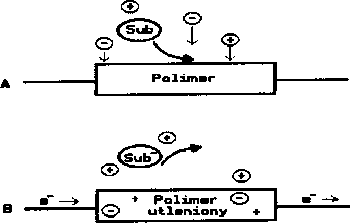
Rys. 7. Polimer jako czujnik substancji.
|
Ponieważ polimery reagując z pewnymi związkami chemicznymi zmieniając swe własności elektryczne lub optyczne, otwiera to drogę do zastosowań takich materiałów w analizie chemicznej. Rys. 7 przedstawia polimer w roli czujnika pewnej substancji (Sub). W jej nieobecności polimer jest izolatorem. Natomiast gdy substancja ta ma dostęp do polimeru, utlenia go i w rezultacie radykalnie zwiększa jego przewodnictwo. Wydaje się, że najlepszym miejscem dla takiego układu są instalacje alarmowe, reagujące na obecność toksycznych bądź niebepiecznych dla otoczenia substancji.
Zastosowania przewodników organicznych można mnożyć. Od folii polimerowych powlekających szyby, ciemniejących lub zmieniających barwę po przyłożeniu odpowiedniego potencjału, poprzez farby przewodzące, materiały antykorozyjne, ekrany chroniące przed promieniowaniem elektromagnetycznym aż do zastosowań tam, gdzie ciężar klasycznych przewodników metalicznych jest istotną wadą, a więc np. w lotnictwie.
Ale to jeszcze nie wszystko...
Do cząsteczek związków organicznych w tym także polimerów przewodzących można przyłączać rozmaite grupy funkcyjne. Wprawdzie synteza zmodyfikowanego polimeru nie jest łatwa, otrzymuje się zwykle produkt o małym przewodnictwie, niemniej atraktyjność otrzymanych materiałów jest chyba w stanie zrekompensować włożony wysiłek.
Możliwych grup funkcyjnych jest bardzo dużo. Mają przy tym rozmaite cechy fizyczne i chemiczne. Nic dziwnego, że powstała idea zbudowania czujników wykorzystujących zmodyfikowane polimery przewodzące, reagujące np. na zmiany natężenia światła, wilgotność, pole magnetyczne, elektryczne, obecność pewnych substancji chemicznych. Oto kilka przykładów.
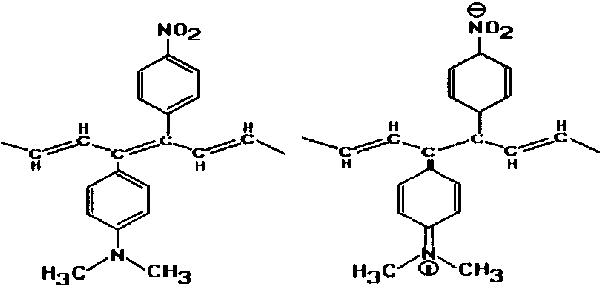 |
| Rys. 8a. Układ przed wzbudzeniem | Rys. 8b. Układ po wzbudzeniu |
Cząsteczka przyłączona do łańcucha poliacetylenowego (rys. 8a) pochłania światło, co w rezultacie prowadzi do przegrupowania elektronów molekuły grupy funkcyjnej. Przy pewnym, odpowiednio dużym natężeniu światła przegrupowanie jest tak znaczne, że przerwany zostaje układ sprzężonych wiązań podwójnych i polimer przestaje przewodić prąd (rys. 8b)
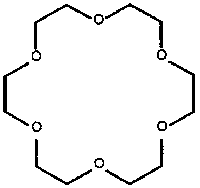
Rys. 9. Eter koronowy 18C6
|
Jeżeli natomiast do łańcucha polimerowego przyłączymy cząsteczkę eteru koronowego (rys. 9), uzyskamy czujnik obecności pewnych kation~w metali. Cząsteczka eteru koronowego ma w środku lukę, w którą może wejść kation o rozmiarach odpowiadających średnicy luki (powstaje związek kompleksowy) i w rezultacie zmienić właściwości elektryczne materiału czujnika. Udane próby takiego układu przeprowadzono z polipirolem i politiofenem.
W literaturze chemicznej pojawiły się też doniesienia o uzyskaniu układu z grupami wyróżniającymi nawet izomery optyczne, czyli cząsteczki tego samego związku chemicznego, ale pozostające do siebie w takiej relacji, jak przedmiot i jego lustrzane odbicie.
Jeszcze inna możliwość to polimer z dołączonymi centrami katalitycznymi, ulokowany na powierzchni elektrody. Uzyskujemy w ten sposób katalizator określonych reakcji elektrochemicznych, nawet tak istotnych z praktycznego punktu widzenia, jak katodowa redukcja wody, CO2, tlenu, czy anodowe utlenianie prostych związków organicznych. Układ taki ma również znaczenie analityczne, ponieważ selektywnie jest ułatwiany przebieg reakcji elektrodowych dla wybranych związków tworzących badaną mieszaninę.
Na koniec zatrzymajmy się przy jeszcze jednej możliwej dziedzinie zastosowań polimerów przewodzących, na razie dość bliskiej fantastyce naukowej, ale zarazem chyba najbardziej fascynującej. Jest to tzw. elektronika molekularna. Wykorzystuje się tu właściwości półprzewodnikowe pewnych związków organicznych, przede wszystkim polimerów. Zatem nic nie stoi na przeszkodzie, przynajmniej teoretycznie, aby takie substancje wykorzystać do budowy diod, tranzystorów i innych pdzespołów (co już nastąpiło), ale także do tworzenia złożonych układów elektronicznych. Różnica w porównaniu z tradycyjną elektroniką krzemową to nie tylko zmiana materiałów nieorganicznych na organiczne. To także szansa zmiany sposobu produkcji.
Możliwa do wyobrażenia, choć na razie mało realna jest nawet chemiczna synteza już gotowego układu elektronicznego. Zauważmy także, że o ile w klasycznym układzie scalonym, nawet o dużej skali integracji, elementem strutury jest krzem, ciało stałe, a więc materiał jednak o charakterze makroskopowym, to w przypadku substancji organicznych elementem elektronicznym może się stać pojedyncza cząsteczka. A to już ma doniosłe konsekwencje... Pojawia się możliwość adresowania, komunikacji z poszczególnymi molekułami. Poza tym układ, w którym pojedyncze cząsteczki tworzą zorganizowaną strukturę zdolną przekazywać i przetwarzać sygnały, przywodzi na myśl coś bardzo nam bliskiego, nasuwa się chyba analogia do pracującego mózgu i układu nerwowego, a przynajmniej jego bardzo uproszczonego modelu. W ten sposób elektronika molekularna dawałaby badaczom narzędzie śledzenia czy symulacji jeszcze wciąż mało poznanych czynności i funkcji organizmu. Czy takie narzędzie rzeczywiście powstanie i czy będziemy umieli się nim posłużyć, pokaże przyszłość
Krzysztof Maksymiuk
Literatura:
- A.Warszawski, Problemy, 2, 1988, 11
- T.Brożek, Problemy, 12, 1985, 14
- R.B. Kaner, A.G. MacDiarmid, Scientific American, 2, 1988, 60
- K. Bechgaard, D. Jerome, Scientific American, 7, 1982, 52
- M. Łapkowski, Wiadomości Chemiczne, 3-4, 1987, 239
KCh 3/91