

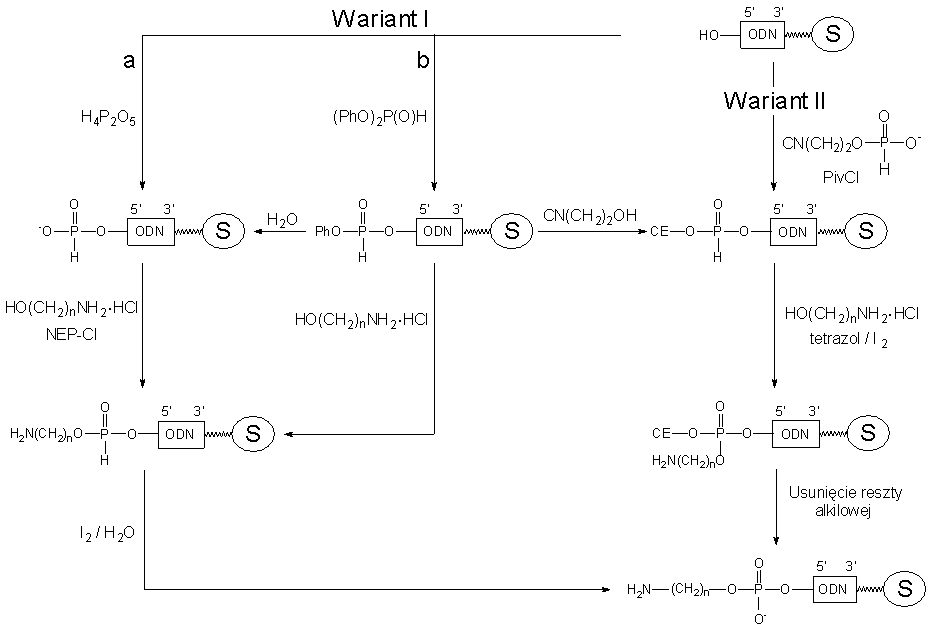
W trójetapowym Wariancie Ia, zastosowanie do fosfonylacji łatwego do otrzymania kwasu pirofosfonowego gwarantowało praktycznie ilościową fosfonylację oligonukleotydu. Kondensacja z chlorowodorkiem aminoalkoholu wobec NEP-Cl także zachodziła niemalże ilościowo i po utlenieniu jodem w warunkach standardowych otrzymywano sfunkcjonalizowany oligonukleotyd jako zdecydowanie główny produkt.
Wariant Ib to również modyfikacja stopniowa, w której do fosfonylacji stosowano odpowiedni nadmiar handlowego fosfonianu difenylowego. Powstający ilościowo w tej szybkiej reakcji, 5'-fenylo-H-fosfonian oligonukleotydu traktowany chlorowodorkiem aminoalkoholu, ulegał ilościowej transestryfikacji do 5'-aminoalilo-H-fosfonianu oligomeru. Po jego utlenieniu (I2/H2O) otrzymywano końcowy pożądany produkt - sfunkcjonalizowany oligonukleotyd, jako niemalże jedyny produkt trzech etapów modyfikacji.
W Wariancie Ib otrzymany na pierwszym etapie 5'-fenylo-H-fosfonian oligonukleotydu można wykorzystać do syntezy innych pochodnych np. zhydrolizować do 5'-H-fosfonianu oligomeru lub w reakcji z 2-cyjanoetanolem przekształcić w 5'-(2-cyjanoetylo)-H-fosfonian oligonukleotydu. Utlenienie i odblokowanie tego ostatniego prowadzi do 5'-fosforanów oligonukleotydów, z możliwością ich wykorzystania do katalizowanej enzymatycznie (T4 DNA ligaza) syntezy dłuższych fragmentów DNA, np. biologicznie funkcjonalnych jednostek genetycznych (promotory, geny struktury i wiele innych).
Ponadto, oprócz cech uniwersalności, Wariant
Ib jest podejściem szczególnym, gdyż na żadnym etapie jego realizacji
nie używa się czynników kondensujących, co może mieć decydujące znaczenie
w przypadkach gdy modyfikacji poddaje się oligonukleotyd niosący ugrupowania
podatne na acylowanie chlorkami acylowymi lub fosforylację chlorofosforanami.
 |
 |
Schemat 45
Funkcjonalizacja oligonukleotydów wg Wariantu II przebiegała zadowalająco jedynie na pierwszym etapie tj. generowania na końcu 5' oligomeru reszty 2-cyjanoetylo-H-fosfonianowej. Do otrzymywania 5'-(2-cyjanoetylo)-H-fosfonianów oligonukleotydów można było stosować dwie, równie wydajne metody, tj. transestryfikację 5'-fenylo-H-fosfonianuoligonukleotydu 2-cyjanoetanolem lub bezpośrednią kondensację 5'-HO-oligomeru z H-fosfonianem 2-cyjanoetylowym wobec PivCl. Natomiast na etapie oksydatywnej kondensacji 5'-(2-cyjanoetylo)-H-fosfonianu oligonukleotydu z chlorowodorkami aminoalkoholi, pożądany sfunkcjonalizowany oligonukleotyd otrzymywano z wydajnościami nie przekraczającymi 50%. Ponieważ analogiczne reakcje prowadzone na związkach modelowych w roztworze zachodziły ilościowo, sądzę, że niepowodzenia w tym przypadku związane są z układem heterogennym, w którym reagenty są w roztworze, a modyfikowany oligonukleotyd w fazie stałej. Niestety, nie miałem technicznych możliwości (31P NMR) śledzenia poszczególnych etapów modyfikacji centrum 5' fosforowego oligonukleotydu związanego z fazą stałą i z konieczności tę sprawę pozostawiłem nie do końca wyjaśnioną.
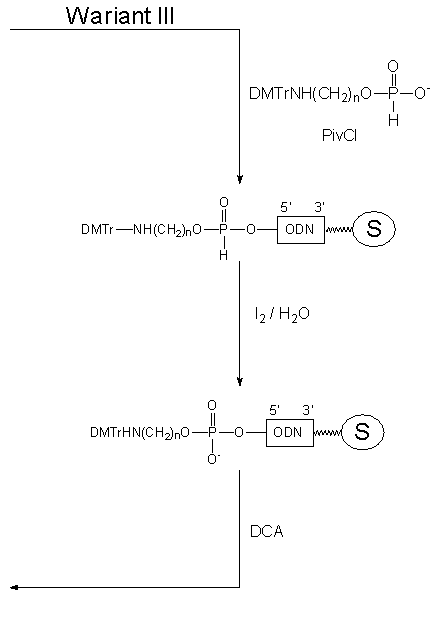
Jak można było się spodziewać, funkcjonalizacja oligonukleotydów wg Wariantu III, w którym oligomer fosfonylowano odpowiednio zablokowanym aminoalkilo-H-fosfonianem, zachodziła szybko i wydajnie. Ponieważ reakcje kondensacji i następnie utleniania prowadzi się w standardowych warunkach syntezy oligonukleotydów (metodą H-fosfonianową), to można cały proces funkcjonalizacji traktować jako dodatkowy cykl syntezy łańcucha oligonukleotydowego.
W niniejszej rozprawie opracowano trzy nowe, stosunkowo proste i jednocześnie efektywne metody funkcjonalizacji oligonukleotydów związanych z podłożem stałym. Wszystkie z nich spełniają stawiane w rozprawie kryteria metodyczne i ekonomiczne. Każda z prezentowanych w rozprawie metod funkcjonalizacji oligonukleotydów oparta jest na różnego typu reakcjach chemicznych i stosuje różne reagenty. Pozwala to na optymalny wybór jednej z nich w zależności od potrzeb i praktycznych możliwości realizacji.
Sfunkcjonalizowane oligonukleotydy znakowano różnymi grupami reporterowymi na podłożu stałym lub w roztworze, wykorzystując handlowo dostępne, aktywne pochodne fluoresceiny, rodaminy i biotyny. Przydatność otrzymanych nieradioizotopowych oligonukleotydowych sond molekularnychzostała sprawdzona z wynikiem pozytywnym w testach analitycznych wykonanych w niezależnych laboratoriach.
Na koniec, mając na uwadze uzyskane wyniki, pozwalam sobie wyrazić pogląd, że w mojej ocenie cele stawiane w niniejszej rozprawie zostały osiągnięte.
