

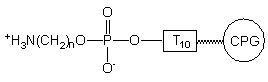
We wstępnych eksperymentach, w których 5'-aminoalkio-oligonukleotyd VI traktowany był izotiocyjanianem fluoresceiny lub estrem 4-nitrofenylowym biotyny, znakowany oligomer XI uzyskiwany był ze stosunkowo niskimi wydajnościami (~20%, PAGE), niezależnie od stężenia reagentów i czasu reakcji.
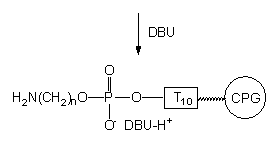
Przypuszczałem, że niska wydajność powyższych reakcji związana jest ze strukturą jonu obojnaczego reszty aminoalkilo-fosforanowej. W tego typu zwitterjonie funkcja aminowa jest sprotonowana, co znacznie obniża jej reaktywność jako nukleofila. Założyłem, że dodanie silnej zasady np. DBU spowoduje przekształcenie struktury zwitterjonu w parę jonową: kation DBUH+ i anion fosforanowy, w którym funkcja aminowa reszty aminoalkilowej nie będzie protonowana. Dlatego też przed przyłączeniem grupy reporterowej przemywałem oligonukleotyd VI 0,2 M roztworem DBU w pirydynie, po czym poddałem go reakcji z izotiocyjanianem fluoresceiny (Schemat 44).
VI
XI
| a: Rep = fluoresceina
b: Rep = biotyna |
Schemat 44
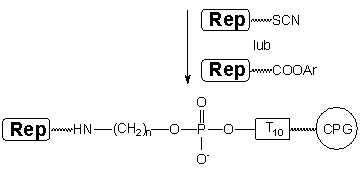
Zgodnie z oczekiwaniem, przyłączenie fluoresceiny było tym razem bardzo wydajne i oligomer XIa był głównym produktem oligonukleotydowym w surowej mieszaninie reakcyjnej (Zdjęcie 6). Szybko migrujące związki (poniżej barwnika XC, linie C i D) związane są prawdopodobnie z produktami przyłączenia izotiocyjanianu fluoresceiny bezpośrednio do podłoża CPG.
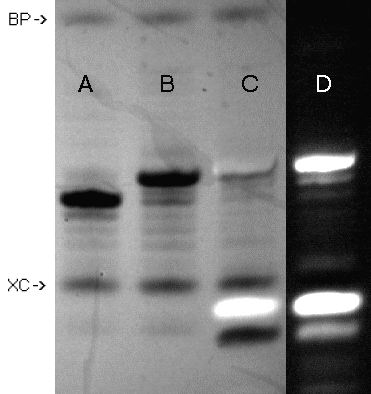
| linia A: T10 (I)
linia B: 5'-aminopentylo-T10 (VI) linia C: XIa, l=254 nm linia D: XIa, l=366 nm |
Zdjęcie 6
Analogiczne podejście zastosowałem w reakcji oligomeru
VI z aktywnym estrem biotyny. W tym przypadku
w trakcie reakcji kondensacji wydziela się 4-nitrofenol (pKa
7,4), który ze względu na swój kwasowy charakter
mógłby ponownie dezaktywować (protonować) funkcję aminową. By
temu zapobiec, kondensacja prowadzona była
w obecności DBU (0,05M). Podobnie jak w przypadku fluoresceiny, otrzymałem
znaczącą poprawę wydajności syntezy znakowanego
biotyną oligomeru XIb (Zdjęcie 7).
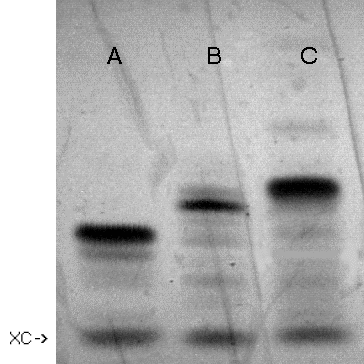
| linia A: T10 (I)
linia B: 5'-aminoalkilo-T10 (VI) linia C: XIb |
Zdjęcie 7
Przedstawiony protokół przyłączania grup reporterowych do sfunkcjonalizowanych oligonukleotydów na podłożu stałym wydaje się być podejściem bardziej ogólnym, umożliwiającym wprowadzanie również innych znaczników, np. izotiocyjanianu rodaminy, estru N-hydroksybursztynimidowego kwasu digoksygenino-3-O-metylokarbonylo-e-aminokapronowego i in.
W przypadku gdy charakter grupy reporterowej nie pozwala na przyłączenie jej na podłożu stałym, możliwe jest wyizolowanie sfunkcjonalizowanego oligonukleotydu i wykorzystanie go do przyłączenia znacznika w roztworze. Przydatność uzyskanych oligomerów w takim podejściu sprawdziłem w reakcji z izotiocyjanianem fluoresceiny i izotiocyjanianem rodaminy. Oligonukleotyd typu VI, 5'-aminopentylo-T10 (Zdjęcie 8, linia A) został rozpuszczony w buforze boranowym pH 9,2 (100 ml), potraktowany roztworem odpowiedniego izotiocyjanianu (1 mg) w DMSO (30 ml) i pozostawiony na noc.101 Po wstępnym oczyszczeniu na kolumnie wypełnionej Sephadexem G-25 (NAP-10, Pharmacia-LKB), analiza na żelu poliakrylamidowym wykazała niemalże ilościowe przyłączenie znaczników fluorescencyjnych, prowadzące do oligomeru niosącego fluoresceinę (Zdjęcie 8, linia B) lub rodaminę (linia C).
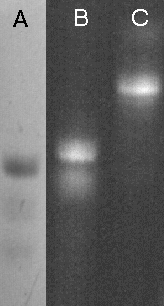
Zdjęcie 8
Skuteczność opracowanych metod otrzymywania nieradioizotopowych sond molekularnych została potwierdzona syntezą znakowanych oligonukleotydów ukierunkowanych na wykrywanie specyficznych sekwencji nukleotydowych (Tabela 12). Sondy te zostały z powodzeniem wykorzystane w doświadczeniach biologicznych.
|
|
|
| 5'-fluoresceina-d(CATACACCTCCAGCACCTAA) |
|
| 5'-biotyna-d(GATCTTCAGT) |
|
| 5'-biotyna-d(CAGGGACAATGTGGT) |
motylicy wątrobowej |
Przykładowy obraz na żelu poliakrylamidowym kolejnych
etapów otrzymywania fluoresceinowej sondy HPV-16 przedstawiony jest na
Zdjęciu 9. Oligomer ten (linia A) został zsyntetyzowany metodą H-fosfonianową,
a funkcjonalizację przeprowadzono według Wariantu III - przyłączając
do oligomeru H-fosfonian N-(4,4'-dimetoksytrytylo)-5-aminopentylowy (linia
B). W ostatnim etapie do oligomeru przyłączona została fluoresceina (linie
C i D). Sonda została odcięta od podłoża stałego i odblokowana wodnym stężonym
roztworem amoniaku. Analogiczne wyniki uzyskane zostały dla pozostałych
sond.
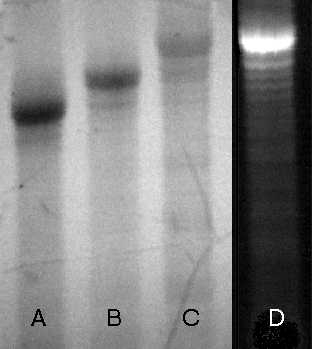
Zdjęcie 9
