
Modyfikacje internukleotydowych grup fosforanowych
Aktualnie stosowane metody syntezy oligonukleotydów oparte są o chemię
fosforu trójwartościowego (amidofosforyny lub wodorofosforyny). W obu stosowanych
metodach powstałe w reakcji kondensacji triestry fosforynowe lub diestry
H-fosfonianowe należy utlenić do fosforanów. Konieczność utlenienia internukleotydowego
wiązania w trakcie lub też po zakończeniu syntezy oligomeru otwiera możliwości
modyfikacji centrum fosforowego. Reakcje utleniania triestrów i diestrów
kwasu fosforawego zachodzą według innych mechanizmów, co zostało wykorzystane
do wprowadzania punktowych modyfikacji reszty fosforanowej ukierunkowanych
na syntezę oligonukleotydowych sond molekularnych niosących nieradioizotopowe
grupy reporterowe.
Modyfikacje prowadzące do amidofosforanów
Ten typ modyfikacji można stosować w przypadku, gdy w oligomerze występuje
diestrowe wiązanie H-fosfonianowe. W podejściu tym wykorzystano fakt, że
utlenianie diestrów wodorofosforynów halogenoalkanami (CCl4)
lub jodem prowadzi w pierwszej kolejności do halogenofosforanów, które
w reakcjach z nukleofilami można przekształcać w pochodne fosforanów. Tak
więc, w reakcjach utleniania wobec nadmiaru wody finalnymi produktami są
diestry fosforanowe. Jeżeli w analogicznej reakcji nukleofilem jest amina,
finalnymi produktami utlenienia są amidofosforany (Schemat 12), które mogą
być wykorzystane do przyłączenia grup reporterowych.
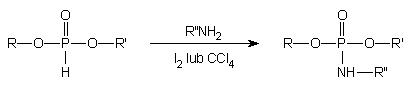
Schemat 12
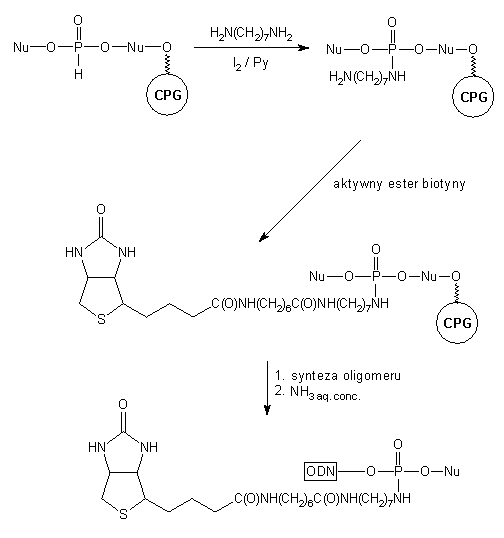
Powyższe właściwości wodorofosforynów wykorzystano w syntezie modyfikowanych
oligonukleotydów111, gdzie do nukleozydu związanego z podłożem
stałym przyłączano następną jednostkę nukleozydową z wytworzeniem diestrowego
wiązania H-fosfonianowego (Schemat 13). Utlenianie (I2) otrzymanego
diestru H-fosfonianowego wobec nieblokowanego 1,7-diaminoheptanu prowadziło
do amidofosforanu N-(7-aminoheptylowego). Do wolnej grupy aminowej przyłączano
aktywny ester biotyny, wprowadzając w ten sposób grupę reporterową i uzyskując
jednocześnie trwałe ugrupowanie podczas dalszej elongacji łańcucha oligonukleotydowego.
Po uwolnieniu z podłoża i odblokowaniu oligomeru otrzymano gotową sondę
z przyłączoną na końcu 3' biotyną jako grupą reporterową (Schemat 13).
Schemat 13
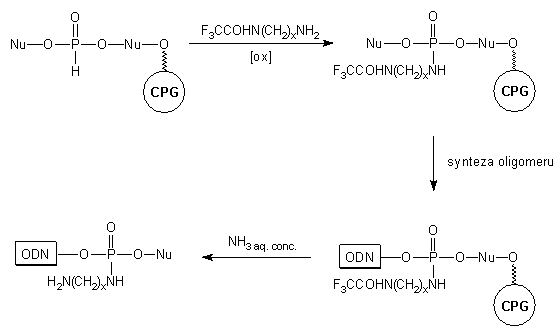
Innym wariantem podobnej modyfikacji może być podejście, w którym jako
nukleofil zastosowano N-trifluoroacetyloalkilodiaminę112-114
(Schemat 14).
Schemat 14
W wyniku oksydatywnej amidacji otrzymywano prekursor sondy oligonukleotydowej
z ugrupowaniem amidofosforowym, w którym funkcja aminowa reszty aminoalkilowej
chroniona była trwałą podczas syntezy oligomeru grupą trifluoroacetylową.
W trakcie odblokowania (NH3 aq. stęż.) odsłaniano także tę funkcję
i dopiero po izolacji sfunkcjonalizowanego oligomeru przyłączano grupę
reporterową.
Analogicznie otrzymano oligomer typu 108 z przyłączoną
w różnych pozycjach łańcucha pochodną wiologenu (bis-czwartorzędową solą
4,4'-dipirydylu, będącą potencjalnym źródłem wolnych rodników) z odsłoniętą
resztą aminową, która nie była chroniona podczas syntezy łańcucha oligonukleotydowego115.
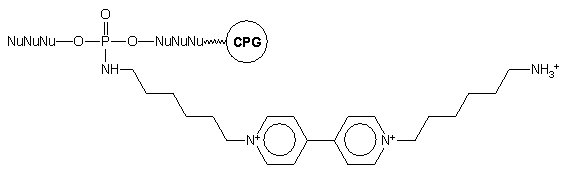
108
Autorzy metody nie dyskutowali wpływu wolnej grupy aminowej w łańcuchu
bocznym na efektywność dalszej syntezy oligonukleotydu.
Dalszym przykładem modyfikacji centrum fosforowego diestrów H-fosfonianowych
jest oksydatywna kondensacja z N-trifenyloacetylocystaminą
109116,
która prowadziła do oligomeru niosącego lipofilową grupę trytylową ułatwiającą
jego oczyszczanie (HPLC - faza odwrócona). Po oczyszczeniu oligomer poddawano
działaniu DTT, pod wpływem którego pękał mostek disiarczkowy i uwalniała
się funkcja -SH, co umożliwiało przyłączanie grup reporterowych np. w reakcjach
alkilowania.
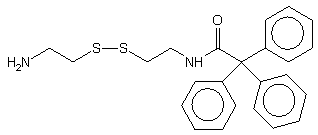
109
Modyfikacje prowadzące do tiofosforanów
Innym sposobem funkcjonalizacji reszty fosforanowej jest przeprowadzenie
jej w pochodną tiofosforanową. Tego typu związki, podobnie jak tiole, podatne
są na reakcje alkilowania, co pozwala na wprowadzenie do oligomeru grupy
reporterowej.
Przykładem takiego podejścia jest szereg reakcji przedstawiony na Schemacie
15. Oligomer związany z podłożem fosforynowano za pomocą trichlorku fosforu
lub salicylochlorofosfiny (2-chloro-5,6-benzo-1,3,2-dioksafosforin-4-onu).
Resztę H-fosfonianową ternalizowano trimetylochlorosilanem i następnie
utleniano siarką elementarną. Powstający tiofosforan alkilowano 1-tlenkiem
2-decylo-2,3,5,5-tetrametylo-4-(3-jodo-2-oksopropylidieno)imidazolu. Tak
otrzymany oligomer odblokowano roztworem amoniaku i wykorzystywano w badaniach
elektronowego rezonansu paramagnetycznego (EPR)46.
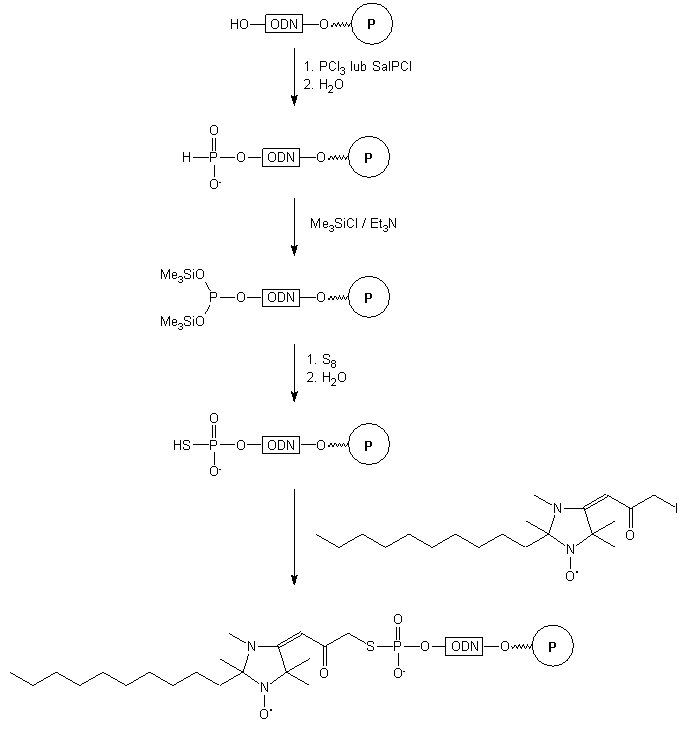
Schemat 15
Innym podejściem pozwalającym na otrzymanie oligonukleotydów zawierających
wiązanie tiofosforanowe jest prowadzenie syntezy oligonukleotydu metodą
amidofosforynową, a jedynie ostatnią kondensację metodą H-fosfonianową.
Ugrupowanie wodorofosforynowe utleniano następnie siarką, uzyskując na
końcu 5' oligomeru diestrową resztę tiofosforanową. Oligonukleotyd odblokowywano
roztworem amoniaku i w reakcji alkilowania wprowadzano takie grupy reporterowe
jak biman, dansyl lub fluoresceinę113.
Kombinacja modyfikacji poprzez amidofosforany
i tiofosforany
Różnice w reaktywności funkcji aminowej i tiofosforanowej pozwalają na
wprowadzenie do oligomeru dwóch różnych grup reporterowych113.
W tym celu w trakcie syntezy oligonukleotydu metodą amidofosforynową dwukrotnie
zastosowano syntony wodorofosforynowe. Pierwszy H-fosfonian wprowadzono
na początku syntezy (koniec 3') i utleniono czterochlorkiem węgla wobec
1-N-trifluoroacetylo-1,6-diaminoheksanu. Drugi synton H-fosfonianowy użyto
na zakończenie syntezy oligomeru (koniec 5') i wiązanie H-fosfonianowe
utleniono siarką. Tak modyfikowany oligomer odblokowano w standardowy sposób
po czym resztę tiofosforanową na końcu 5' alkilowano selektywnie monobromobimanem
{3,6,7-trimetylo-4-bromometylo-1,5-diazabicyklo[3.3.0]okta-3,6-dien-2,8-dionem}(znacznik
fluorescencyjny). Funkcję aminową łańcucha aminoalkilowego na końcu 3'
wykorzystano do przyłączenia biotyny (w postaci estru aktywnego) lub fluoresceiny
(w postaci izotiocyjanianu, uzyskując sondę oligonukleotydową typu 110.
Stosowanie oligomerów z przyłączonymi w określonych pozycjach łańcucha
dwiema różnymi grupami reporterowymi powinno uprościć prowadzenie takich
badań jak np. analiza strukturalna DNA, oddziaływania DNA - białko czy
dynamika kwasów nukleinowych.
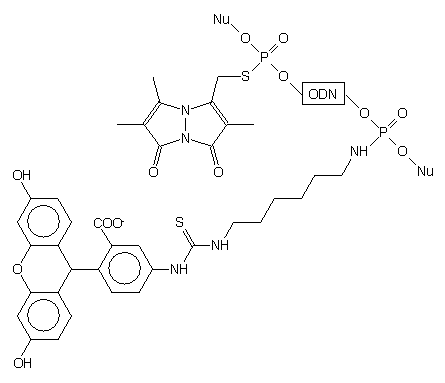
110
Inne metody modyfikacji
Pisząc o modyfikacjach internukleotydowych reszt fosforanowych prowadzących
do oligomerów z nieradioizotopowymi grupami reporterowymi, warto wspomnieć,
że modyfikacje mogą być wykorzystane do innych celów, np. w badaniach rentgenograficznych.
Przykładem może być praca Dalla Riva Tomy i Bergstroma117, którzy
wprowadzili atom wolframu do wiązania internukleotydowego w reakcji triestru
fosforynowego z pentakarbonylo(h2-cis-cyklookteno)wolframem(0).
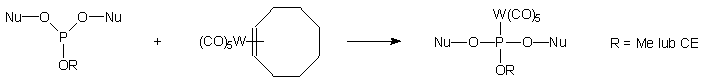 111
111
Dinukleotydy typu 111 otrzymano w roztworze, jak i na
podłożu stałym, jednak wydajności reakcji były bardzo niskie (16 - 25%).
Próby zastosowania powyższego podejścia do modyfikacji oligonukleotydów
zakończyły się niepowodzeniem.
Podsumowanie
Modyfikacje wiązania internukleotydowego dają możliwości otrzymywania oligonukleotydów
znakowanych nieradioizotopowo w różnych (również wielu) pozycjach i z różnymi
łącznikami. Metody te są atrakcyjne także dlatego, że można je łatwo modyfikować,
podobnie jak w etapowym modyfikowaniu końca 5'. Wady tego podejścia to
powstawanie diastereoizomerów oraz konieczność zachowania bezwodnych warunków
podczas utleniania.



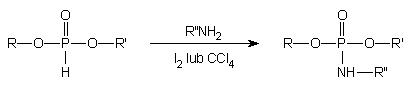






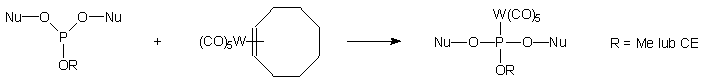 111
111